Agatha eTMFとは
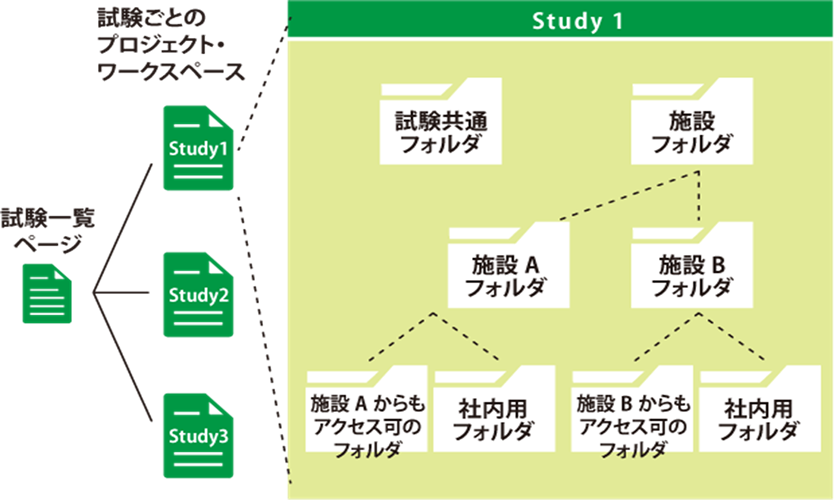
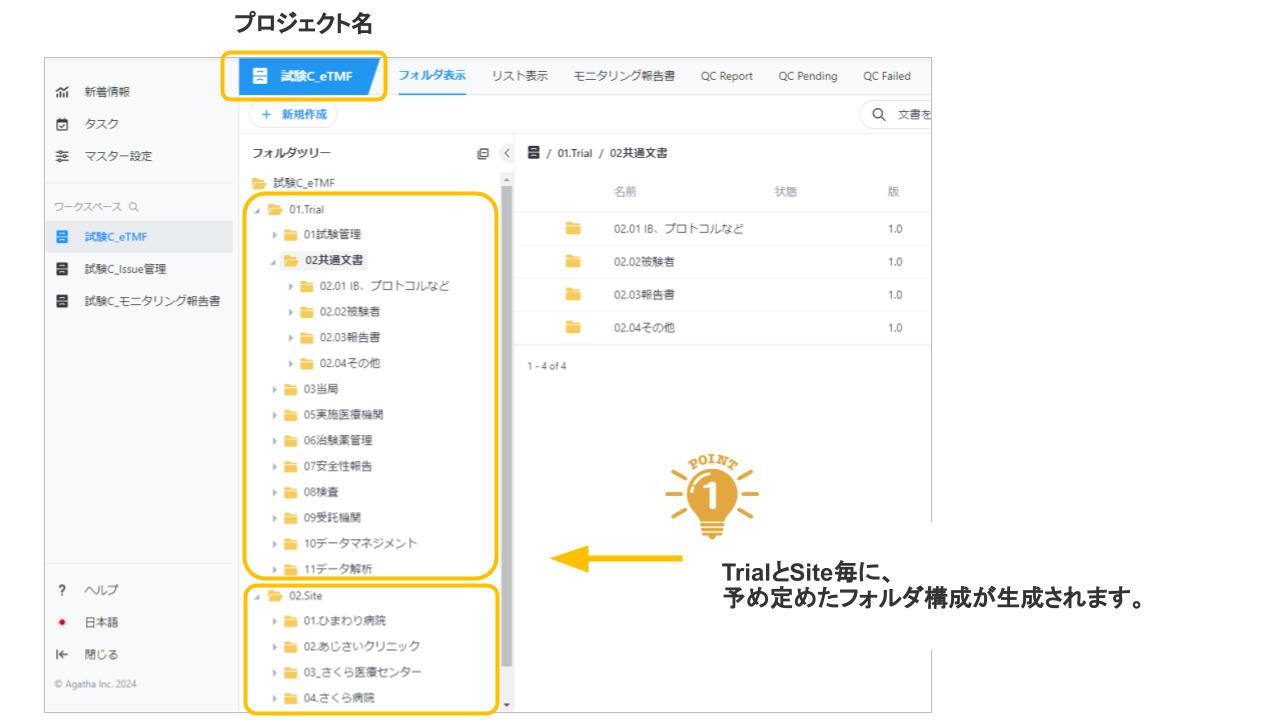
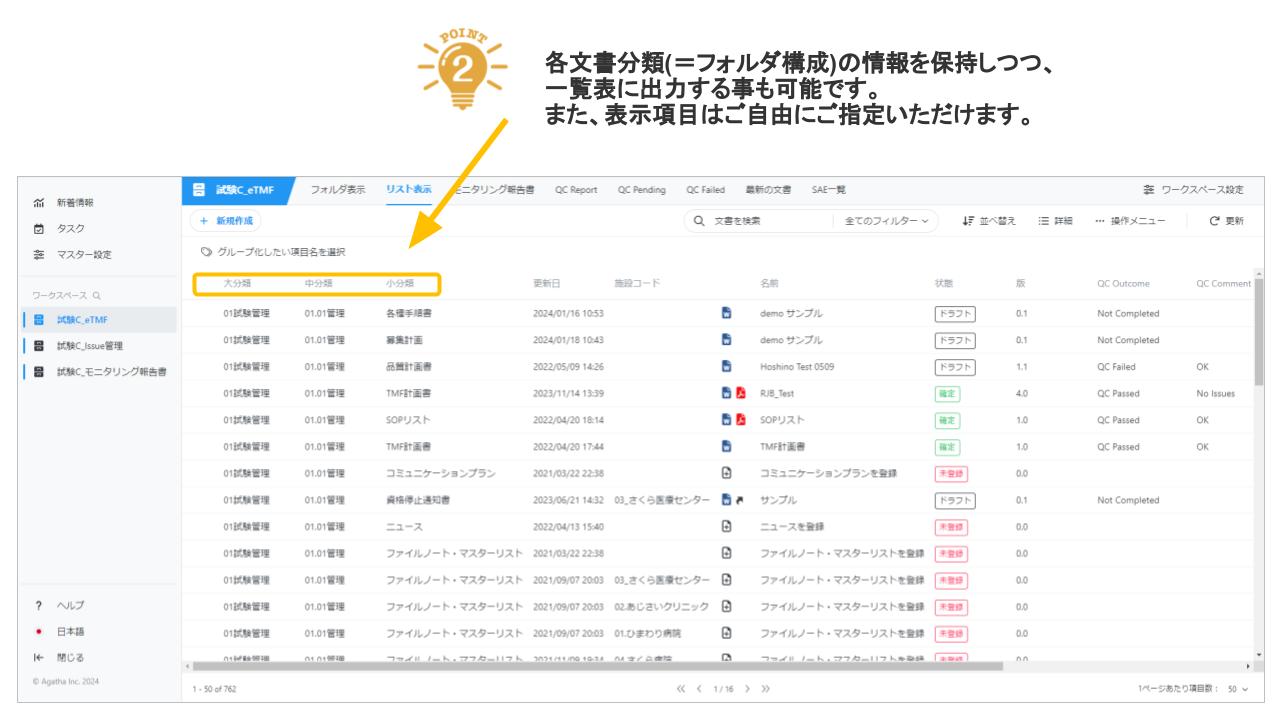
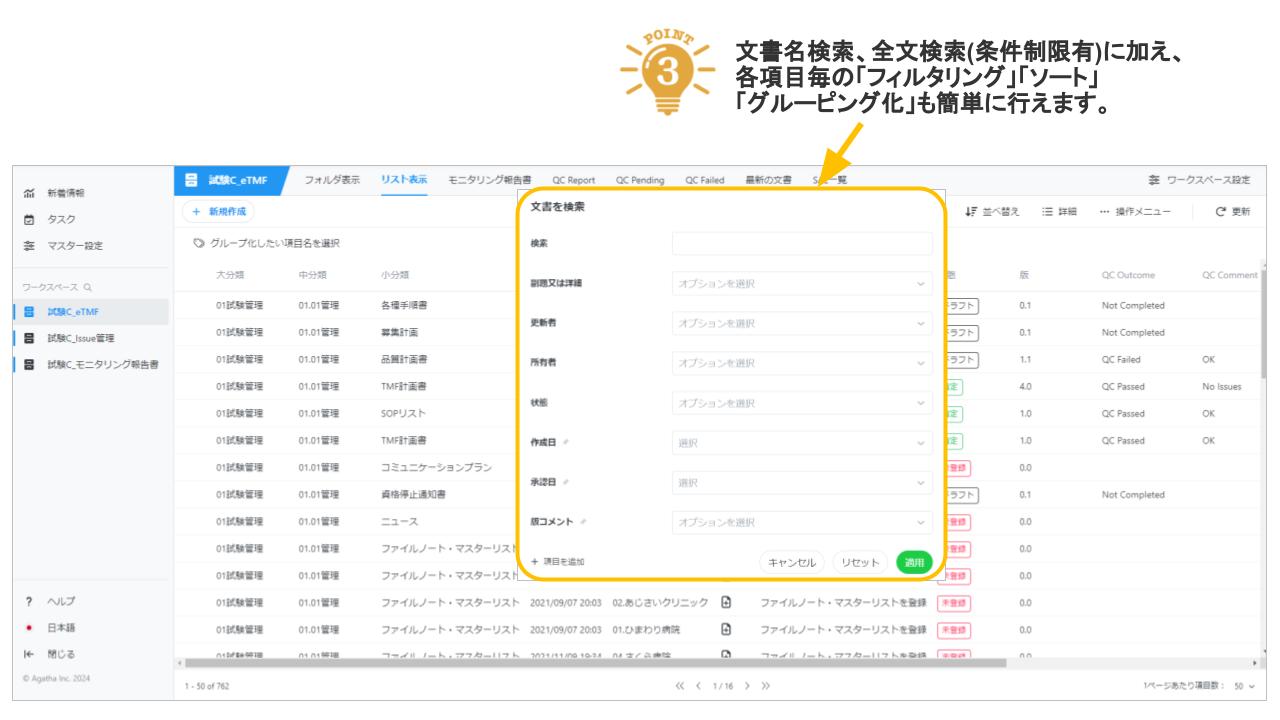
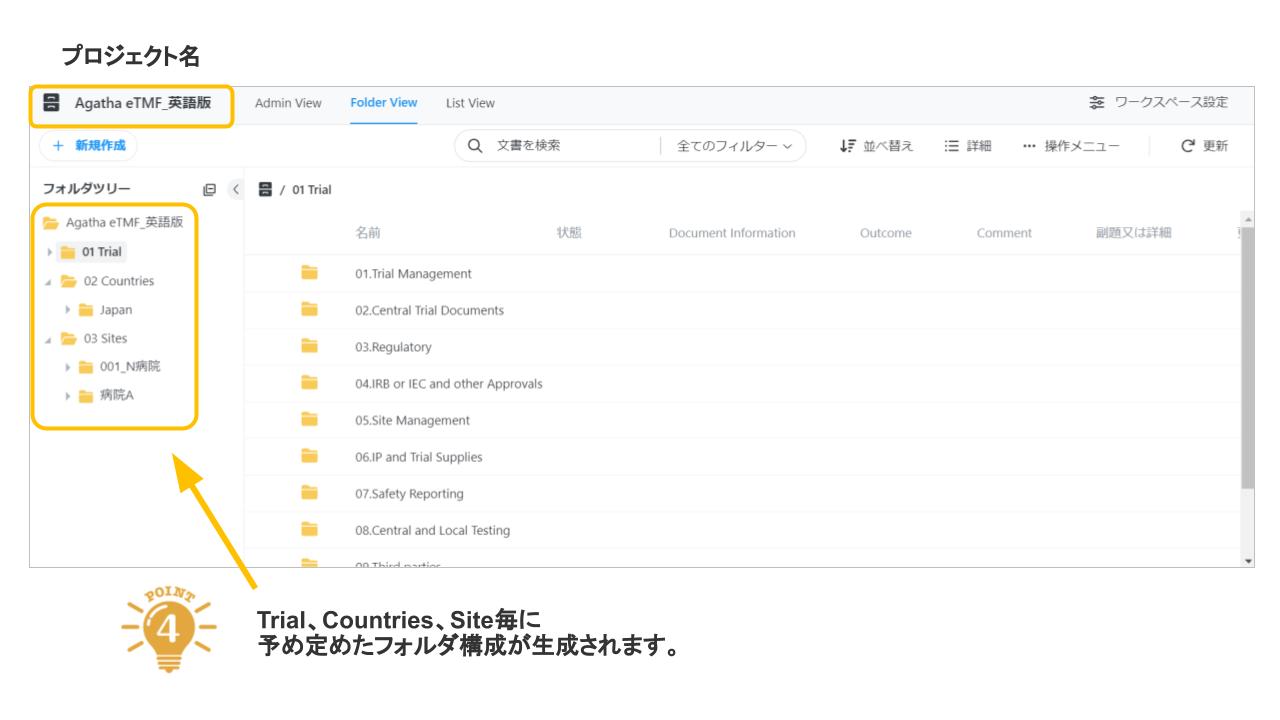
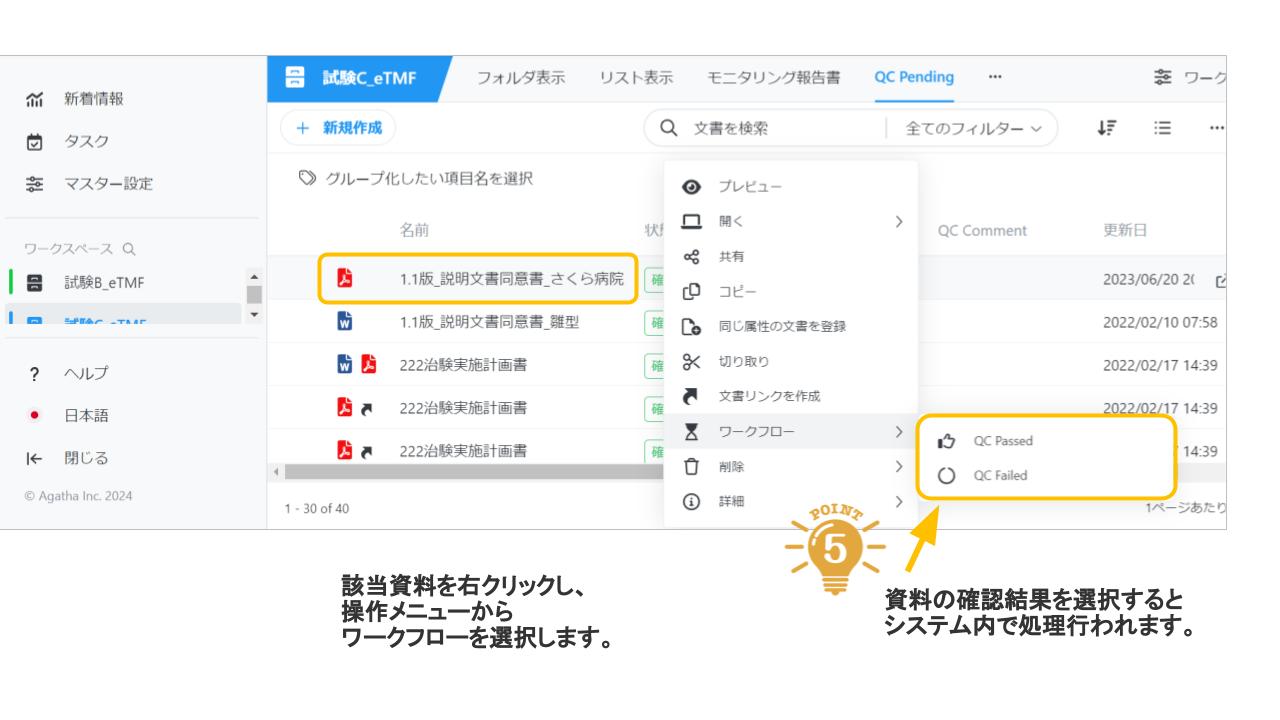
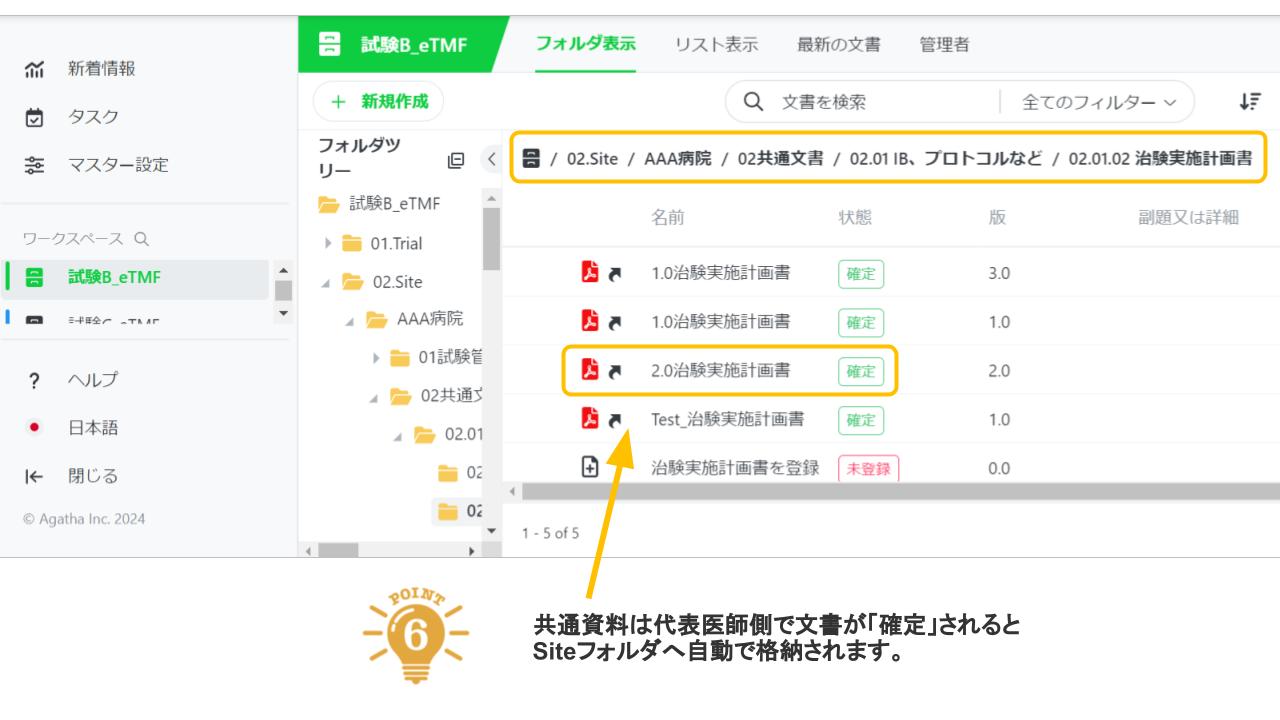
Agatha eTMFは、治験必須文書・治験関連文書を、プロジェクト単位で作成・共有・保管するための文書管理クラウドサービスです。数百種類の文書の管理するため、業界標準のフォルダ・文書構成を設定済みで、簡単にスピーディーに環境を作成することが可能です。スポンサー、実施医療機関、委託先の間の治験文書に関するあらゆる業務(文書の共有・編集・印刷・送付・保管・モニタリングなど)を、信頼性を確保しつつ、劇的に効率化・省力化します。お客様の試験に合わせた構成を選ぶことが可能です。
・TMF Reference Model
・企業治験 日本語版
・特定臨床研究
・医師主導治験